基本信息
- 项目名称:
- 利用接头插入技术构建环型T载体(pYCQ1)
- 来源:
- 第十一届“挑战杯”国赛作品
- 小类:
- 生命科学
- 大类:
- 自然科学类学术论文
- 简介:
- 试验巧妙利用Ⅲ型核酸内切酶XcmⅠ的酶切特点,设计了含有3′ 突出 A末端的接头(接头中含有2个串联的XcmⅠ酶切位点)。通过接头与pMD18–T载体的连接与连接产物的转化,得到了可复制的重组载体(pYCQ1)。利用XcmⅠ对pYCQ1进行充分酶切便能得到T载体。整个制备过程简单便捷,省时省力。
- 详细介绍:
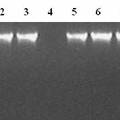
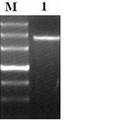
- 人工设计接头序列,其特点为含有3′ 突出 A末端,同时人工接头序列内部含有XcmⅠ、Bsp M901、AceⅡ酶切位点。利用人工接头3′ 突出 A与线性的pMD18–T载体的3′ 突出T连接,将线性的pMD18–T载体改造成环形具有自身复制功能的pYCQ1载体,降低了实验室使用T载体的成本,同时增加了载体的克隆位点。 当利用pYCQ1制备T载体时,只需要用XcmⅠ酶切(XcmⅠ限制性片段具有3′ T末端)pYCQ1载体可以得到线性的3′ T粘性末端的pYCQ1-T载体。实验验证,pYCQ1载体可以在受体菌E.coli DH5α中进行大量自我复制,pYCQ1–T载体能够克隆1800bp的外源PCR产物。
作品专业信息
撰写目的和基本思路
- 目的:将线性pMD18-T载体改造成环型可复制的质粒载体,降低实验室使用T载体的成本,同时增加载体酶切位点数目。 思路:人工设计含有3′突出A末端的接头序列,利用人工接头3′突出A与线性的pMD18-T载体的3′突出T连接,形成重组载体。利用重组载体作为T载体时,用XcmⅠ酶切(XcmⅠ限制性片段有3′T末端)pYCQ1载体可以得到线性的3′T粘性末端的pYCQ1-T载体。
科学性、先进性及独特之处
- 本研究所做工作为国家自然科学基金项目(30871566)、黑龙江省自然科学基金项目(C2007-37)中内容之一。由于在上述项目中有较多需测序的地方,本研究的完成大大降低T载体使用成本,节省了科研经费。本研究的先进性在于构建了可复制的前载体(环型质粒),制备T载体时不需人工合成3′T碱基。只需对提取的前载体进行XcmⅠ的酶切就可得到。整个制备过程简单省钱,得到的T载体高效。属国内先进水平。
应用价值和现实意义
- (1)本研究所改造的质粒载体pYCQ1既可以用来制备T载体,还能做为一般的克隆载体来使用。 (2)当利用pYCQ1载体制备pYCQ1-T载体时,我们只需将质粒进行XcmⅠ酶切及目的片段的回收。操作简单,且得到的T载体克隆效率较高,能够连接较长的PCR产物。 (3)pYCQ1载体的成功构建大大降低了实验室使用T载体的成本,在许多需要测序的试验中节省了较多科研经费。
学术论文摘要
- 人工设计接头序列,其特点为含有3′突出A末端,同时人工接头序列内部含有XcmⅠ、Bsp M901、AceⅡ酶切位点。利用人工接头3′突出A与线性的pMD18-T载体的3′突出T连接,将线性的pMD18-T载体改造成环形具有自身复制功能的pYCQ1载体,降低了实验室使用T载体的成本,同时增加了载体的克隆位点。利用pYCQ1作为T载体时,用XcmⅠ酶切(XcmⅠ限制性片段具有3′T末端)pYCQ1载体可以得到线性的3′T粘性末端的pYCQ1-T载体。实验验证,pYCQ1载体可以在受体菌E.coli DH5α中进行大量自我复制,pYCQ1-T载体能够克隆1 800 bp的外源PCR产物。
获奖情况
- 已投稿的文章: 杨成泉等:《利用接头插入技术构建环型 T载体(pYCQ1)》,已被《黑龙江大学自然科学学报》接收。
鉴定结果
- 该三位同学试验设计严谨,试验方法得当,试验数据真实可靠。达到预期结果。
参考文献
- [1] James M C. Novel non-templated nucleotide addition reactions catalyzed by procaryotic and eucaryotic DNA polymerases[J]. Nucleic Acid Res, 1988, 16, 9677-9686. [2] 陈 波.一种简单高效的5′ 突出末端平端化方法[J].生物技术,2007, 17(3): 38-39. [3] 董 玲, 陈创夫, 韩亚杰,等. Klenow大片段聚合酶及T4DNA聚合酶在构建重组质粒中的应用[J]. 石河子大学学报, 2006, 24(2): 170-172. [4] Cha J, Bishsi W, Chandrasegaran S, et al. New vectors for direct cloning of PCR products[J]. Gene, 1993, 136:369-370. [5] Dagert M, Enrlich S D. Prolonged incubation in calcium chloride improves the competence of Escherichia colicells[J]. Gene, 1979, 6(1): 23-28. [6] Sambrook J, Fritsch E F, Maniats T. Molecular Cloning: A Laboratory Manual[M]. 2nd. Beijing: Science Press, 2003.
同类课题研究水平概述
- 自上世纪90年代PCR技术广范应用至今,T载体的制备技术一直是一个热门话题。迄今为止,已经有两类制备T载体的技术被认为是能够制备出具有高效连接效率的T载体: (1)在线性化平末端载体的3′末端加上一个T,制备T载体。 该技术出现较早,现在大部分商品化T载体都是基于此制备的。1990年Marchuk等人将载体切出平末端,在缺乏dATP 及存在过量dTTP的情况下,用Taq DNA聚合酶的核酸转移酶活性催化,在3′末端加上一个dT,得到了T载体。同年,Holton等人由Sanger的DNA测序原理得到启发,用脱氧核苷酸末端转移酶(TDT) 在线性化载体的3′末端加上双脱氧胸腺嘧啶核苷酸(ddTTP),也得到了T载体。自此,各国科学家在近20年的时间里基于上述原理不断进行改进与优化,获得了各种质粒的T载体形式。而在改进的过程中,线性化载体的形式渐渐地由平末端的载体转向3′突出的粘性末端载体。2008年,中国农业科学院武晓丽进一步优化了该技术:利用PstI 充分酶切纯化的质粒pUC19,再用T4 DNA聚合酶消化15min,然后电泳、凝胶回收获得T载体,试验中对自制T载体的功能验证表明:该载体自连率低,假阳性低。 (2)构建用于制备T载体的前载体,利用酶切前载体的方法获得T载体。 该技术起步较晚,许多国内实验室基于此构建载体并申请了专利。该技术的核心是利用一些Ⅲ型核酸内切酶特异识别位点对前载体酶切,从而得到线性T载体。而在构建前载体时,应选用一个合适的筛选系统。现在已报道的筛选系统有:蓝白筛选系统、甘露聚糖水解酶(水解圈)筛选系统、毒素蛋白致死筛选系统与温度敏感致死筛选系统等。除了蓝白筛选系统外,其他筛选系统均为近5年内完成构建工作的。2004年,Han Geun Kim等利用XcmⅠ对pTOC载体进行酶切得到了pTOC-T载体,该T载体基于ParE毒素蛋白表达致死系统,进行阳性克隆子筛选。重组载体可以在较多大肠杆菌菌株细胞内复制。2005年,马洪等构建了质粒pMD-18Tman2XcmI。用XcmI酶切质粒pMD-18Tman2XcmI可以制备T载体。该T载体基于甘露聚糖水解酶(水解圈)筛选系统,进行阳性克隆子筛选。2009年西南大学的马越等构建了基于温度敏感致死筛选系统的T载体。文中提到,转化得到重组子均为阳性。