基本信息
- 项目名称:
- 免疫组织化学双重标记创新改良
- 来源:
- 第十二届“挑战杯”省赛作品
- 小类:
- 生命科学
- 大类:
- 科技发明制作B类
- 简介:
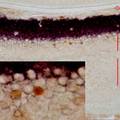
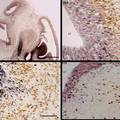
- 病理研究常需在同一种细胞内检测两种不同蛋白,传统方法步骤繁多,组织容易脱片,导致实验失败。我们改良的创新点之一是将两种不同种属的抗体混在一起,两抗体间无交叉反应.特异性较高,即使细胞内抗原量少也能检测,从而克服了传统方法因步骤繁多而致实验失败等缺点。创新点之二是首次使用DAB和4-chloro-1-naphthol组合,两种蛋白分别显示棕黄色和紫黑色,形成鲜明对比,特异性强,无背景染色。
- 详细介绍:
- 在病理形态学研究及病理学医疗实践中,经常需要检测两种不同蛋白是否在同一组织或同一种细胞中共存,因此出现了免疫组织化学双重标记。此方法有几种类型,包括免疫酶组织化学和免疫荧光细胞化学法结合;同一切片的再度染色法(先对第一种抗原染色,阳性部位拍照,再用酸处理使抗原抗体解离,继之,对第二种抗原染色、拍照);两种酶标抗体双重染色(分别用辣根过氧化物酶和碱性磷酸酶标记第二抗体.用间接法分别显示A和B抗原),这种方法很费时间,第一天加入第一种第一抗体后,4度过夜,第二天显色后,经过必要的处理,再加入第二种第一抗体,再次4度过夜,然后第二次显色。以上过程耗时耗力,步骤繁多,组织容易脱片,导致实验失败。我们对免疫组化双重标记改良的创新点之一主要是将不同种属来源的抗体混在一起进行双重染色,两种抗体间无交叉反应.特异性较高,即使细胞内抗原量很少也能检测。从而克服了传统方法因为步骤繁多而导致的费时耗材甚至组织脱片,实验最终失败等缺点。创新点之二是在国内首次使用了DAB和4-chloro-1-naphthol组合,两种蛋白分别显示棕黄色和紫黑色。目前国内的石蜡组织切片双重标记几乎全部采用DAB和AEC两种显色剂,DAB为棕黄,AEC为红色,两种颜色反差小,染色结果不够清晰,特异性差。我们首次选用4-chloro-1-naphthol和DAB作为石蜡组织切片的免疫组化双标显色剂,棕黄色和紫黑色形成鲜明对比,染色结果清晰漂亮,特异性强,无背景染色。目前正在准备试剂盒的开发。
作品专业信息
设计、发明的目的和基本思路、创新点、技术关键和主要技术指标
- 在病理形态学研究及病理学医疗实践中,经常需要检测两种不同蛋白是否在同一组织或同一种细胞中共存,因此出现了免疫组织化学双重标记。此方法有几种类型,包括免疫酶组织化学和免疫荧光细胞化学法结合;同一切片的再度染色法(先对第一种抗原染色,阳性部位拍照,再用酸处理使抗原抗体解离,继之,对第二种抗原染色、拍照);两种酶标抗体双重染色(分别用辣根过氧化物酶和碱性磷酸酶标记第二抗体.用间接法分别显示A和B抗原),这种方法很费时间,第一天加入第一种第一抗体后,4度过夜,第二天显色后,经过必要的处理,再加入第二种第一抗体,再次4度过夜,然后第二次显色。以上过程耗时耗力,步骤繁多,组织容易脱片,导致实验失败。我们对免疫组化双重标记改良的创新点主要是将不同种属来源的抗体混在一起进行双重染色,两种抗体间无交叉反应.特异性较高,即使细胞内抗原量很少也能检测。本研究的技术关键首先清楚两种蛋白的细胞定位,避免在同一细胞的同一部位两种蛋白共存,其次是根据不同的组织,采用不同的抗原修复时间,最后显色封片后在光镜下清楚的观察到两种蛋白显示不同的颜色,特异性强,清晰无背景染色。
科学性、先进性
- 我们的改良创新方法,与传统的方法相比,有明显的优势。传统的方法费时费力,要经过两次4度过夜,从实验开始到结束需要3天时间,敏感度差,步骤繁多,容易导致组织破碎、脱片,最终染色失败。经过创新改良的方法省时省力,将不同种属来源的两个第一抗体混在一起进行双重染色,两种抗体间无交叉反应,两种蛋白分别显示棕黄色和紫黑色,对比鲜明,敏感度高,操作简便,特异性强,无内源性生物素干扰。
获奖情况及鉴定结果
- 采用此改良方法的研究论文已被SCI收录杂志接收。
作品所处阶段
- 实验室应用阶段
技术转让方式
- 自行研发使用
作品可展示的形式
- 图片
使用说明,技术特点和优势,适应范围,推广前景的技术性说明,市场分析,经济效益预测
- 改良方法: ⑴切片脱蜡至水 ⑵将切片在3%的H2O2中孵育10分钟⑶蒸馏水冲洗 ⑷抗原修复 (微波抗原修复30分钟,PH6.0枸橼酸盐 缓冲液)⑸PBS冲洗,2分钟x3次⑹即用型封闭液 滴加1滴于组织上湿盒中孵育20分钟 ,弃去溶液,勿洗⑺小鼠来源的一抗和兔来源的一抗(合适的浓度)混匀滴加在切片上4度过夜⑻ PBS冲洗,2分钟x3次⑼滴加二抗聚合物(分别为碱性磷酸酶标记的山羊抗小鼠IgG和辣根过氧化物酶标记的山羊抗兔IgG)30分钟⑽PBS冲洗2分钟x3次⑾滴加DAB显色液镜下观察控制显色,蒸馏水冲洗以终止反应,滴加4-chloro-1-naphthol显色剂镜下观察控制显色,然后水溶性封片剂封片 此方法的优势是省时、省力、节约试剂,实验结果准确,清晰无背景染色,特异性强。可用于石蜡切片、冰冻切片。目前准备开发试剂盒,如能顺利完成,将可为病理学基础研究及临床鉴别诊断提供简单、快捷、高效、实用的方法并有良好的经济效益。
同类课题研究水平概述
- 在病理形态学研究及病理学医疗实践中,经常需要检测两种及两种以上不同蛋白是否在同一组织或同一种细胞中共存,因此出现了免疫荧光多重标记,共聚焦显微镜下观察。我国目前的形态学研究现状是共聚焦显微镜的价格昂贵使用还很局限,但普通的免疫组化技术已经遍布所有的形态学研究室及临床病理科,因此我们本着从实际出发的原则,在普通免疫组织化学双重标记上做了创新改良。 迄今为止普通免疫组化双重标记法有几种类型,包括免疫酶组织化学和免疫荧光细胞化学法结合;同一切片的再度染色法(先对第一种抗原染色,阳性部位拍照,再用酸处理使抗原抗体解离,继之,对第二种抗原染色、拍照);两种酶标抗体双重染色(分别用辣根过氧化物酶和碱性磷酸酶标记第二抗体.用间接法分别显示A和B抗原),这种方法很费时间,第一天加入第一种第一抗体后,4度过夜,第二天显色后,经过必要的处理,再加入第二种第一抗体,再次4度过夜,然后第二次显色。以上过程耗时耗力,步骤繁多,组织容易脱片,导致实验失败。我们对免疫组化双重标记改良的创新点之一主要是将不同种属来源的抗体混在一起进行双重染色,两种抗体间无交叉反应.特异性较高,即使细胞内抗原量很少也能检测;创新点之二是首次使用了4-chloro-1-naphthol 作为显色剂,4-chloro-1-naphthol显色后为紫黑色与DAB的棕黄色形成鲜明的对比。 采用本实验方法首先要清楚两种蛋白的细胞定位,避免在同一细胞的同一部位两种蛋白共存,其次是根据不同的组织,采用不同的抗原修复时间,最后显色封片后在光镜下清楚的观察到两种蛋白显示不同的颜色,特异性强,清晰无背景染色。 我们的改良创新方法,与传统的方法相比,有明显的优势。传统的方法费时费力,要经过两次4度过夜,从实验开始到结束需要3天时间,敏感度差,步骤繁多,容易导致组织破碎、脱片,最终染色失败。经过创新改良的方法省时省力,将不同种属来源的两个第一抗体混在一起进行双重染色,两种抗体间无交叉反应,两种蛋白分别显示棕黄色和紫黑色,对比鲜明,敏感度高,操作简便,特异性强,无内源性生物素干扰。